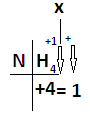01)
(UFMG) Entre as reações
indicadas, a única que envolve transferência de elétrons é:
a) AgNO3 (aq) + NaCl(aq) --> AgCl(s) + NaNO3(aq)
a) AgNO3 (aq) + NaCl(aq) --> AgCl(s) + NaNO3(aq)
b) CaCO3(s) --> CaO(s) +
CO2(g)
c) CaO(s) + H2O(l)
--> Ca(OH)2(aq)
d) H2O2(l) --> 2H2O(l)
+ O2(g)
e) Pb2+(aq) +2Cl - -->
PbCl2(s)
02) (UFJF) Na obtenção
industrial do ácido nítrico é utilizado o processo de Ostwald, no qual a última
etapa envolve a reação:
3 NO2(g) + H2O(l)
--> 2HNO3(aq.) + NO(g)
Assinale a
alternativa incorreta:
a) esta é uma reação de oxi-redução;
b) nesta reação, a água
é agente oxidante;
c) o NO2 é um
óxido ácido;
d) o ácido nítrico é um
monoácido;
e) o NO é um óxido
neutro.
03) (PUC-MG/JUNHO) Um dos métodos
empregados para remover a cor escura da superfície de objetos de prata consiste
em envolvê-los em folha de alumínio e mergulhar o sistema am água fervente com
sabão de coco (meio básico). A equação que representa a reação é:
Al(s) + Ag2S(s)
 Al+3(aq)
+ S-2(aq) + Agº(s)
Al+3(aq)
+ S-2(aq) + Agº(s)
Em relação à
transformação ocorrida, assinale a afirmativa INCORRETA:
a) O alumínio sofre oxidação e, portanto, é o agente redutor.
b) O composto Ag2S é o agente oxidante, pois contém o elemento prata (Ag) que provoca a oxidação.
c) A soma dos coeficientes mínimos e inteiros das espécies químicas, após o balanceamento da equação, é igual a 16.
d) O número de oxidação do Al varia de 0 para +3 no processo.
e) A prata doa elétrons, e seu número de oxidação passa de +1 para 0.
a) O alumínio sofre oxidação e, portanto, é o agente redutor.
b) O composto Ag2S é o agente oxidante, pois contém o elemento prata (Ag) que provoca a oxidação.
c) A soma dos coeficientes mínimos e inteiros das espécies químicas, após o balanceamento da equação, é igual a 16.
d) O número de oxidação do Al varia de 0 para +3 no processo.
e) A prata doa elétrons, e seu número de oxidação passa de +1 para 0.
04) (FUNREI) Com relação à reação
Zn + HgSO4 --> ZnSO4 + Hg,
qual é a afirmativa INCORRETA?
a) A reação é do tipo oxirredução.
a) A reação é do tipo oxirredução.
b) O zinco foi o
agente redutor.
c) O número de
oxidação do enxofre não variou.
d) O mercúrio se
oxidou pela ação do zinco.
05) (FADI-UBÁ) Introduzindo uma
chapinha de cobre no ácido nítrico concentrado, ocorre uma reação química
evidenciada pela liberação de um gás castanho e pela oxidação do Cu (cobre).
Todas afirmativas baseadas ao texto são verdadeiras, EXCETO:
a) a coloração azul da solução evidencia os íons cobre.
a) a coloração azul da solução evidencia os íons cobre.
b) ocorreu no frasco
uma reação de decomposição do cobre.
c) a chapa de cobre
diminui de tamanho.
d) ocorreu no frasco
uma reação de oxi-redução.
06) (FADI-UBÁ) As roupas coloridas
podem ser desbotadas quando usamos uma solução aquosa de NaClO (hipoclorito de
sódio) conhecido comercialmente como água sanitária. A análise de alguns íons
clorados mostrou para o cloro uma variação do estado de oxidação. Tais fatos nos
permitem concluir que:
a) o cloro sofreu uma oxidação.
a) o cloro sofreu uma oxidação.
b) o cloro sofreu uma
redução.
c) ocorreu uma reação
de neutralização ácido-base.
d) ocorreu uma reação
de oxi-redução.
07) (UFV) Considere as seguintes equações:
I - HCl + NaOH --> NaCl + H2O.
II - H2 +
1/2 O2 --> H2O.
III - SO3
+ H2O --> H2SO4.
Ocorre oxirredução
apenas em:
a) I.
d) I e III.
b) II.
e) II e III.
c) III.
08) (UFV-96) O permanganato de
potássio (KmnO4) pode ser obtido a partir do minério conhecido como
pirolusita (MnO2). As reações envolvidas no processo são:
2MnO2 + 4KOH + O2 --> 2K2MnO4 + 2H2O
2K2MnO4 + Cl2 --> 2KmnO4 + 2KCl
2MnO2 + 4KOH + O2 --> 2K2MnO4 + 2H2O
2K2MnO4 + Cl2 --> 2KmnO4 + 2KCl
Assinale a afirmativa
CORRETA:
a) MnO2 e Cl2
atuam como agentes redutores.
b) KOH e K2MnO4
atuam como agentes redutores.
c) K2MnO4
e O2 atuam como agentes oxidantes.
d) KOH e O2
atuam como agentes oxidantes.
e) O2 e Cl2
atuam como agentes oxidante
09) (PUC-RIO
2008)
O fenômeno da oxirredução ocorre em reações com
transferência de elétrons. Sobre a reação do permanganato de potássio com
peróxido de hidrogênio em meio ácido, representada pela equação não balanceada
abaixo, uma espécie doa elétrons, e a outra recebe esses elétrons de maneira espontânea,
o que pode ser verificado pela variação do número de oxidação.
Sobre essa reação, é correto afirmar que:
a)
o manganês no permanganato de potássio tem Nox 5+.
b)
permanganato de potássio é a substância oxidante.
c)
ácido sulfúrico é o agente redutor.
d)
o oxigênio no peróxido de hidrogênio tem Nox médio 1+.
e)
peróxido de hidrogênio é a substância que sofre redução.
10) (FUVEST 2010)
Na produção de combustível nuclear, o trióxido de
urânio é transformado no hexafluoreto de urânio, como representado pelas equações
químicas:
Sobre tais transformações, pode-se afirmar,
corretamente, que ocorre oxirredução apenas em:
a)
I.
b)
II.
c)
III.
d)
I e II.
e)
I e III.
11) (UDESC 2010)
Abaixo são dados os potenciais padrões de redução
dos metais prata e ferro, a 25 ºC.
Coloca-se uma barra de prata em uma solução aquosa
de FeSO4 1,0 mol.L-1, a 25 ºC. Com relação ao que deve
ocorrer com o sistema acima, pode-se afirmar que:
a)
a equação global da reação é:
b)
a barra de prata deve reagir com o FeSO4
c)
o FeSO4 deve favorecer a oxidação da prata pela água em
presença de oxigênio.
d)
sendo a diferença de potencial igual a -0,36V, nas condições padrões a
reação é espontânea.
e)
sendo a diferença de potencial –1,24 V, nas condições padrões, nenhuma
reação deve ocorrer.
12) (FUVEST 2009)
A pólvora é o explosivo mais antigo conhecido pela
humanidade. Consiste na mistura de nitrato de potássio, enxofre e carvão. Na
explosão, ocorre uma reação de oxirredução, formando-se sulfato de potássio,
dióxido de carbono e nitrogênio molecular. Nessa transformação, o elemento que
sofre maior variação de número de oxidação é o:
a)
Carbono.
b)
Enxofre.
c)
Nitrogênio.
d)
Oxigênio.
e)
Potássio.
13) (UFPB 2009)
(Adaptado)
3CH3CH2OH
+ 2K2Cr2O7 + 8H2SO4
→ 3CH3COOH + 2Cr2(SO4)3
+ 2K2SO4 + 11H2O
Na reação acima, as substâncias oxidante e redutora
são respectivamente:
a)
K2Cr2O7 e CH3CH2OH
b)
CH3COOH e K2Cr2O7
c)
CH3COOH e H2SO4
d)
K2Cr2O7 e CH3COOH
e)
H2SO4 e CH3COOH
01) d
02) b
03) e
04) d
05) b
06) d
07) b
08) e
09) b
10) e
11) e
12) b
13) a